Nature|四川大学华西医院高原医学中心邓成教授团队揭示

鸟类是脊椎动物中生理特点最独特的一类,拥有轻盈的体型和结实的肌肉,能够支持快速的代谢率,同时,其循环系统和呼吸系统也具有高效的氧气供应能力1–3。在脊椎动物中,血糖水平通过特定的反馈机制在代谢过程中得到精细调控,维持物种特有的稳态。然而,这种稳态在鸟类中被打破4。1893年,Minkowski5等人发现鸟类血糖相比其他脊椎动物普遍较高。动物体内的血糖水平主要通过胰高血糖素受体(GCGR)家族进行调节,这一受体家族在脊椎动物中广泛存在,并具有较高的基因序列相似性与功能保守性6,7。虽然鸟类和哺乳动物在糖脂代谢过程上有相似之处,但其代谢机制上存在进化差异。一个世纪以来,鸟类高血糖的分子机制成为未解的“百年科学之谜”。
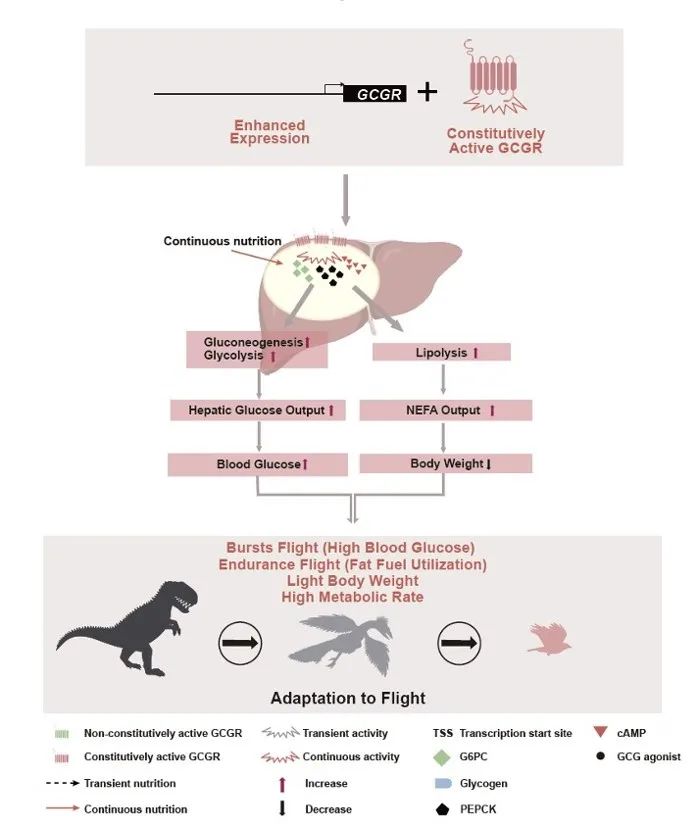
图1 组成型活性GCGR调节代谢促进飞行生理适应的机制模型
在该研究中,研究团队通过对大量脊椎动物GCGR家族受体进行分子进化分析和组成型活性筛选,揭示鸟类GCGR表现出显著的组成型活性,并且在肝脏中具有高水平的表达。与非胎盘哺乳动物的GCGR存在较弱的组成型活性不同,胎盘哺乳动物的GCGR几乎不具备组成型活性(图2),但其肝脏GCGR水平较高。相比之下,绝大多数非哺乳类脊椎动物肝脏中的GCGR表达较低,但具有较强的组成型活性。
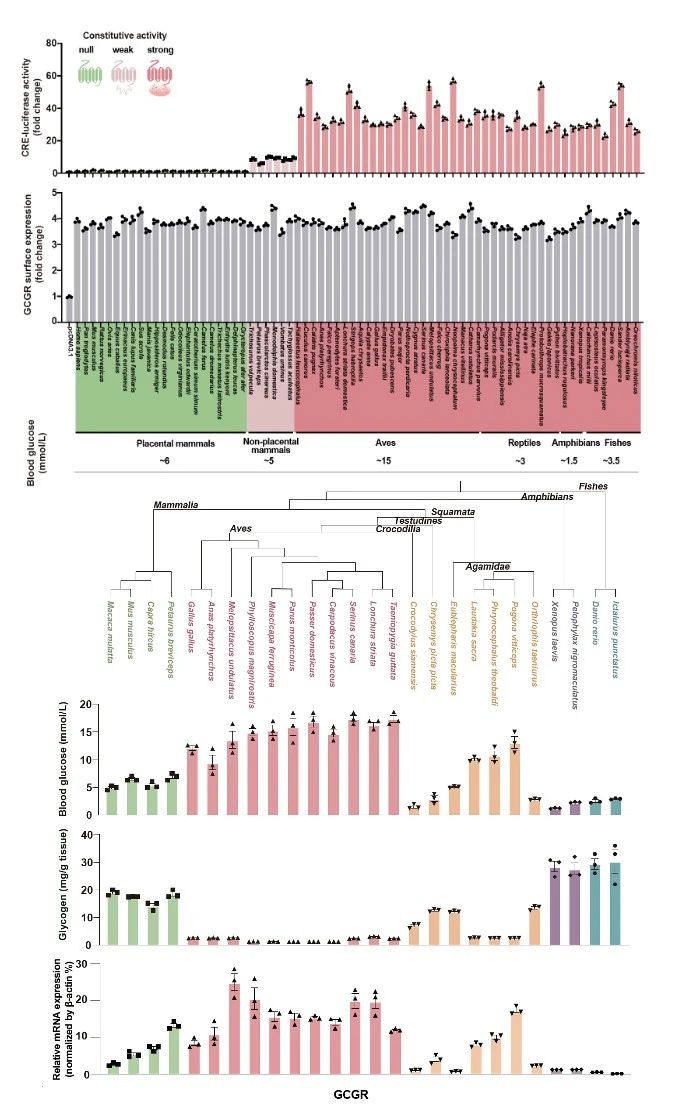
图2 组成性活性GCGR在鸟类肝脏高表达
通过在斑马鱼、鬃狮蜥蜴、豹纹守宫、鸡、虎皮鹦鹉、白腰文鸟和小鼠中进行体内(AAV载体和基因编辑),验证了组成型活性GCGR的过表达与干扰能够显著影响不同物种的基础血糖水平,且参与调节糖脂代谢和能量代谢通路(图3)。研究团队通过广泛筛选,发现人类GCGR的一个自然点突变hsGCGRH339R具有较弱的组成型活性。肝脏中过表达hsGCGRH339R的小鼠表现出高血糖和体重轻的表型。此外,通过对鸡进行育种筛选,研究还发现了可能影响GCGR基因表达水平的启动子区域点突变位点。
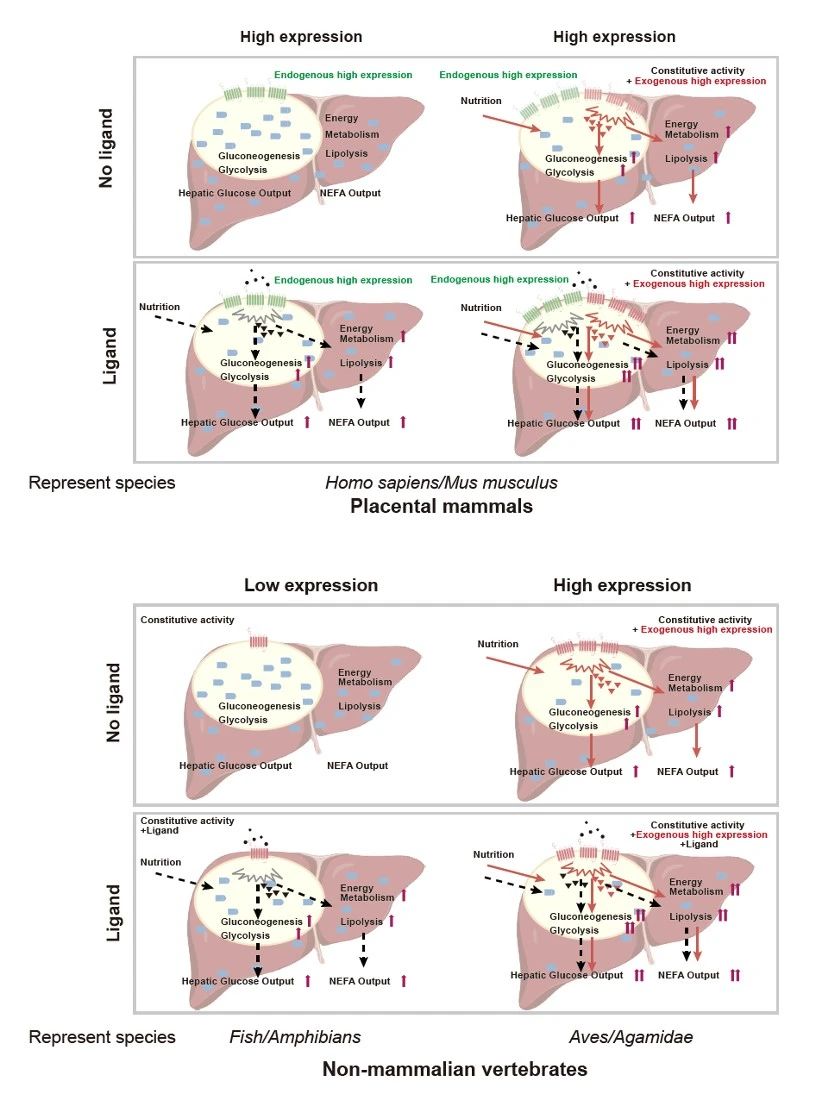
综上所述,组成型活性的GCGR像是一个开关,始终处于部分开启状态(即没有完全的关闭开关)但仍然可以通过其配体以及其表达水平增加进一步激活,促进糖代谢、脂质代谢和能量代谢。首先,葡萄糖作为鸟类短期飞行的主要能源,组成型活性GCGR促进的高血糖满足剧烈飞行时对能量供应的需求,尤其是在飞行爆发时。与非鸟类恐龙和爬行动物相比,鸟类在飞行适应过程中发生了重要的生理变化,即基础代谢率的提高。因此,研究团队提出鸟类GCGR的调控可能在一定程度上促进了鸟类适应性飞行生理的发展,从而为理解多样化的生理适应提供了新思路。
四川大学华西医院博士生张畅、博士生向香盈为共同第一作者; 四川大学华西医院高原医学中心邓成教授为本论文通讯作者。四川大学华西医院Juergen Brosius教授、中国科学院动物研究所詹祥江教授、西北工业大学邱强教授、东北林业大学杨仕隆教授、上海海洋大学胡鹏教授为合作作者。该项目得到了国家自然基金、国家重点研发计划、国家科技重大专项、四川省科技厅、四川大学华西医院1•3•5计划项目和四川大学华西医院国家老年医学临床研究中心的支持。
